آمین ها: کاربرد در صنایع
آمین ها مشتقاتی از آمونیاک هستند که یک یا چند هیدروژن آنها با یک گروه آلکیل یا آریل جایگزین شدهاند. به عبارت دیگر در یک آمین، اتم هیدروژنِ آمونیاک با یک یا چند گروه هیدروکربنی جایگزین شده است. گروههای آمینی که به یک آروماتیک متصل باشند موسوم به آمینهای آروماتیکی هستند. از پیشوند «آمینو» (amino−)(amino−) یا پسوند آمین برای نامگذاری این ترکیبات بهره میگیرند. ترکیبات آلی که دارای چندین گروه آمین باشند را با نامهای دیآمین، تریآمین، تتراآمین و … میشناسند.
آمین ها را می توان با توجه به ماهیت و تعداد جایگزین های موجود در نیتروژن طبقه بندی کرد.
آمین های آلیفاتیک: که فقط حاوی جایگزین های H و آلکیل هستند.
آمین های معطر: که دارای اتم نیتروژن متصل به یک حلقه معطر هستند.
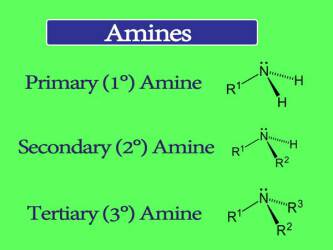
آمین ها، آلکیل و آریل به طور یکسان، بر اساس تعداد اتم های کربن مجاور نیتروژن در سه گروه سازمان یافته اند. این ترکیبات آلی جزو بازها به شمار می روند و شامل یک اتم نیتروژن مرکزی و یک یا دو یا سه گروه آلکیل متصل به آن هستند، که به ترتیب آمین نوع یک، آمین نوع دو و آمین نوع سه نامگذاری میشوند :
آمین های اولیه (1 درجه):
آمین های اولیه هنگامی به وجود می آیند که یکی از سه اتم هیدروژن موجود در آمونیاک توسط یک گروه آلکیل یا آمین معطر جایگزین شود. آمین های اولیه مهم شامل متیل آمین، بیشتر اسیدهای آمینه و عامل بافر هستند، در حالی که آمین های معطر اولیه شامل آنیلین هستند.
آمین های ثانویه (2 درجه):
خاصیت بازی آمین نوع دوم از بقیه بیشتر بوده. آمین های ثانویه دارای دو جایگزین آلی (آلکیل، آریل یا هر دو) هستند، که همراه با یک هیدروژن به نیتروژن متصل می شوند. نمایندگان مهم شامل دی متیل آمین می باشند. در حالی که نمونه ای از یک آمین معطر می تواند دی فنیل آمین باشد.
آمین های سوم (3 درجه):
در آمین های نوع سوم، نیتروژن دارای سه جایگزین آلی است. به عنوان مثال می توان به تری متیل آمین که بوی خاص ماهی دارد.
آمین آروماتیک
موادی هستند که در آنها آمین به حلقه آروماتیک یا هترو آروماتیک اتصال دارد که با توجه به ساختمان حلقه و نیتروژن، این حلقه باعث زیاد شدن توانایی اسیدی و کم شدن ویژگی بازی آمین های آروماتیک می شود.
خواص فیزیکی آمین ها
پیوندهای هیدروژنی بر ویژگی های آمین های اولیه و ثانویه تاثیر دارند.
نقطه جوش آمین ها از فسفین های مانند خود بیشتر بوده و از الکل ها کمتر است.
آمین ها بویی مثل آمونیاک داشته ولی آمین های مایع بویی مثل بوی ماهی دارند.
آمین ها در آب انحلال پذیرند.
انحلال پذیری با زیاد شدن اتم کربن کم شده، زیرا ویژگی آبگریزی با افزایش تعداد اتم کربن، زیاد می شود.
آمین های آلیفاتیک در حلال های آلی قطبی، حل می شوند.
آمین های آروماتیک، به علت داشتن جفت الکترون های ناپیوندی که به حلقه داده شده باعث کاهش پیوندهای هیدروژنی در آن می شود.
در آمین های آروماتیک حلال پذیری در آب کم بوده ولی نقطه جوش بالایی دارند.
خواص اسیدی و بازی آمین ها
این مواد نسبت به هیدروکسید فلزات قلیایی، بازهای ضعیف تری هستند.
گروه های آلکیلی موجب افزایش خصلت بازی و انرژی جفت الکترون ناپیوندی می شوند.
گروه های آریلی باعث تضعیف خصلت بازی می شوند.
حلقه های آروماتیک جفت الکترون های ناپیوندی را از نیتروژن به حلقه بنزنی منتقل کرده که سبب کاهش خصلت بازی می شود.
کاربردهای آمینها
رنگ
آمین های آروماتیک نوع اول جهت تولید «رنگهای آزو» (Azo Dyes) بکار گرفته میشوند. این مواد با نیترو اسید واکنش و نمکهای دیآزونیوم را تشکیل میدهند. این نمکها در نهایت در واکنشهای جفتشدن شرکت میکنند و «ترکیبات آزو» (Azo Compounds) را بوجود میآورند. از آنجایی که ترکیبات آزو رنگی هستند، به طور گسترده در صنایع رنگرزی مورد استفاده قرار میگیرند. برخی از این ترکیبات عبارتند از:
داروها
بسیاری از داروها به منظور مداخله در عملکرد پیامرسانهای عصبی یا تقلید از آنها طراحی میشوند که برخی از آنها در زیر آورده شدهاند:
کلرفنامین، نوعی آنتی هیستامین است که در صورت بروز اختلالات آلرژیک ناشی از سرماخوردگی، تب، حساسیت پوستی و نیش حشرات تجویز میشود.
افدرین و «فنیل افرین» (Phenylephrine) به عنوان ضد احتقان بکار میروند.
برخی از مسکنها همچون مورفین و کدئین از جمله آمینهای نوع سوم هستند.
فرآوری گاز
از مواد زیر به طور صنعتی برای حذف دیاکسید کربن و «سولفید هیدروژن» (H2S)(H2S) از گاز طبیعی استفاده میکنند:
اتانولآمین MEA
دیگلایگولآمین (DGA)
دیاتانول آمین (DEA)
دیایزوپروپانول آمین (DIPA)
متیل دیاتانول آمین (MDEA)